Calculer Le Ph D Une Solution D Acide Fort Exercice
10, 8 11, 8 12, 8 12, 0 À 25 °C, une solution aqueuse de base forte est concentrée à c=8{, }0\times10^{-2} mol·L -1. On rappelle que le produit ionique de l'eau vaut, à cette même température, K_e=1{, }0\times10^{-14}. 13, 3 11, 9 14, 0 12, 9 Exercice précédent
- Calculer le pH d'une solution d'acide fort - Tle - Exercice Physique-Chimie - Kartable
- De math
- Du droit
- Francais
Calculer le pH d'une solution d'acide fort - Tle - Exercice Physique-Chimie - Kartable
L'ion argent se r�duit: d�p�t d'argent sur la plaque de cuivre. oxydant / r�ducteur: Fe 2+ / Fe et est un m�tal moins r�ducteur que le fer: rien ne se passe. Quel est la concentration en ion H + d'une solution aqueuse contenant 0, 01 mol/L de H 2 SO 4? Quel est le pH de la solution? L'acide sulfurique est un diacide fort; H 2 SO 4 = 2 H + (aq) + SO 4 2-. [H + (aq)] = 2*0, 01 = 0, 02 mol/L. pH = - log 0, 02 = 1, 7. On m�lange 1 L de NaOH � 0, 1mol/L � un litre de HCl � 0, 1 mol/L. Quelle est la concentration en ions H + dans le m�lange ainsi form�. On se trouve dans les proportions stoechiom�triques: la solution finale est une solution de chlorure de sodium de pH=7. Concentration en ion oxonium [ H + (aq)] = 10 -7 mol/L. Il faut 12 mL d'une solution d'iode � 0, 1 M pour oxyder totalement 10 mL de thiosulfate de sodium en Na 2 S 2 O 3. Quelle est la concentration en mole du thiosulfate de sodium? Couples oxydant / r�ducteur: I 2 /I -: I 2 + 2e - = 2I -. S 4 O 6 2- / S 2 O 3 2-: 2S 2 O 3 2- = S 4 O 6 2- + 2e - I 2 + S 4 O 6 2- +2I -.
De math
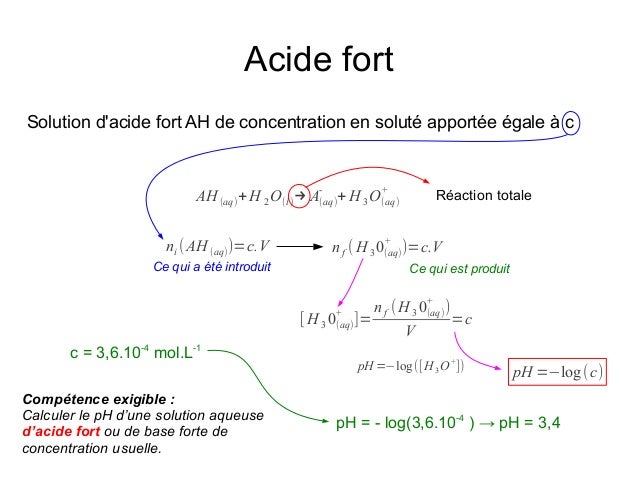
- Calculer le ph d une solution d acide fort exercice se
- Calculer le ph d une solution d acide fort exercice sur
- Calculer le ph d une solution d acide fort exercice pour
Du droit

Francais
Exercice corrigé de calcul du pH d'une base faible l'ammoniac C=1, 0. 10-5 mol. L-1 - YouTube
Bonjour ma1234: Concentration de ta solution de NaOH: 0, 05 mol/L ou 5 x 10^-2. Le pH correspond à [H+]=10-^ph ou pH = -log [H+] ou encore pH = colog [H+] Tu cherche le log de 5 = 0, 69897 tu inverses le signe = -0, 69897 puis tu l'ajoute à 10^-2 = 10^-2 + (-0, 69897) = 1, 3 ( = à pOH) On sait que pH + pOH =14, donc le pH = 14-1, 3 = 12, 7. Comme les acides forts et les bases fortes sont totalement dissociés dans l'eau, le pH augmente d'une unité pour une dilution de 10 fois; donc on a un pH de 12, 7 pour une solution 0, 05 molaire, on aura après dilution de 10 fois un pH de 11, 7 pour une solution 0, 005 mol/L En résumé: la dilution d'un acide fort de 10 fois, le pH augmente d'une unité A neutralité le pH = 7 la dilution d'une base forte de 10 fois, le pH diminue d'une unité. Bonnes salutations.
Nous allons commencer par calculer la concentration de l'espèce considérée dans la solution. La quantité de HNO 3 présente a été donnée en moles, donc pour trouver la concentration on procède comme suit, en pensant bien à prendre le volume en litres: Ainsi avec C = 6, 40×10 -1 mol. Étant donné qu'elle contient un acide fort le pH se calcule comme suit: pH β = 0. 2 Solution γ: Nous avons ici le mélange d'une base faible et d'un acide fort, ce qui veut dire que les molécules réagissent. Il faudra faire un tableau d'avancement pour trouver les détails de la réaction. Pour ça nous allons d'abord calculer les quantités de matière des deux espèces mises dans le mélange en moles: n α = C α × V α = 4, 83×10 -1 × 6, 00×10 -2 = 2, 90×10 -2 moles n β = C β × V β = 6, 40×10 -1 × 1, 50×10 -2 = 9, 60×10 -3 moles HNO 3 est un acide fort qui en réagissant va donner un ion indifférent ou spectateur incapable d'influencer la valeur finale du pH. C'est donc inutile de se préocuper de cet ion par souci de temps, d'où le remplissage immédiat de sa colonne par des croix.